—— GMP咨询 ——
PAI(Pre-Approval Inspection)-批准前检查
发布时间:2021-02-23 /} 浏览次:数
1.简介
批准前检查是各国药品监管机构在药品获得批准前对药学研制和生产现场的检查形式,目的是确保药品在上市前能够持续满足其注册资料的质量要求。而且在我国的仿制药质量和疗效一致性评价的检查参照注册现场检查执行。
cGMP检查的分类
1) 注册批准前检查(Pre-Approval Inspection,PAI)
2) 常规cGMP检查(Routine cGMP Inspection),例如每两年一次
3) 查因调查”检查 (“For Cause” Inspection)
2.批准前检查要点
2.1研制现场检查
1)研制机构质量管理情况
2)处方和工艺与注册资料的一致性
3)研制样品试制记录的可追溯性
4)原辅料与直接接触药品的包装材料和容器的研究
5)质量控制和质量研究
6)技术转移
7)对照品和参比制剂可追溯
8)稳定性研究
9)数据可靠性
2.2生产现场核查要点
1)生产现场的质量管理情况
2)厂房与设施、设备
3)物料的放行和使用
4)批量生产工艺控制
5)质量控制和稳定性试验
6)数据可靠性
3. ANDA PAI流程
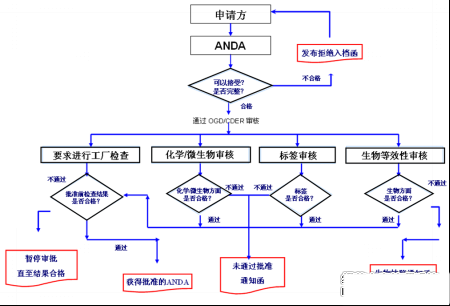
3.1. PAI现场检查的常规程序
① GMP检查办公署预先向某企业发出通知函;将于某时间进行现场检查,且会注明针对该企业申报的某原料药申报或仿制药申报;通常提前一个月左右。
② 企业回复,表明是否同意接受检查;检查日期是可以商量更改的。
③ 官方机构确定检查时间并通知企业其行程,委托企业帮助预定符合规定的酒店等。
④检查员到达后,通常会和企业领导会面,现场检查从仓储到生产等各个部门,了解企业的生产设备和设施,审阅企业的SOP和各类相关文件,现场检查分析和微生物实验室,结束检查前召开现场检查结束会。
3.2. 和检查官一起进行检查结束会议
① 列出所有的不足或缺陷;
② 讨论并尽可能澄清解释,减少写进483报告的内容;
③ 迅速整改或者迅速制定整改措施。
3.3. 陪同进行现场检查的一些技巧和注意事项
① 适当的欢迎方式,表明企业对接受检查的重视。
② 见面会的安排,参加人员的筛选,真实全面和有吸引力的企业介绍,专业的翻译人员---最好企业的关键岗位领导人能够用英语进行交流。
③ 安排随行工作人员,其中一人负责记下所有的问题和回答,并注明检查员的评语、建议等。
④ 车间现场最好能够有正常的生产活动。
⑤ 有问必答,但只回答直接相关问题;并且不一定要马上现场回答,很具体的问题可以在调查清楚后再回答。
⑥ 简单干净的午餐;适当的晚餐。如果检查员坚持付费,应尊重其意见;任何时候都不要送礼物给检查员。
4.凯瑞德提供的服务
4.1模拟PAI
凯瑞德认证部门依据企业产品及剂型特点抽选在QA、生产、QC、注册等各方面有丰富经验的专家组建审计团队,进行模拟审计,为企业查漏补缺。
4.2专业提升
为企业量身定制提升方案,专业团队跟踪企业的差距整改情况,在具体实施中帮助企业解决疑难问题,建立完善质量体系。
4.3持续改进
在企业进行研制工作之初即介入质量管理工作,为企业解决注册和质量研究等技术问题的同时,提升质量管理水平,避免临阵磨枪的仓乱。
5.凯瑞德的优势
5.1专业的团队
拥有专业的质量团队、研发实验室及人员,凭借多次的迎检经验为客户进行全方位咨询。
5.2专业的服务
凯瑞德国际认证团队始终把客户利益摆在中心位置,充分听取客户需求,理解客户疑难,考虑企业间的差异,为每一个客户量身打造合规方案。
