—— 药品注册 ——
医疗器械注册
发布时间:2018-06-06 /} 浏览次:数
1. CFDA注册
中国食品药品监督管理局
CFDA管理着中国注册业务。注册时,先完成产品技术要求。依据产品技术要求,产品在官方指定的检测中心进行检测。获得检测报告后,完成其他所需的注册资料后递交给CFDA进行注册。
医疗器械分类
中国医疗器械分类
Class I 低风险的医疗器械
ClassⅡ 中等风险的医疗器械
ClassⅢ 高风险的医疗器械
注册所需的资料
产品技术资料
产品综述资料
临床评价资料
检测报告
标签和说明书
产品技术要求
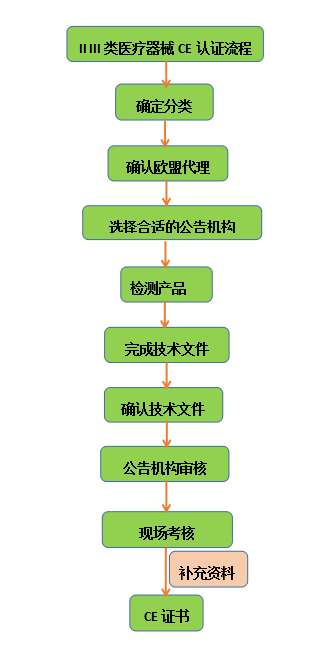
CFDA注册流程
Step 1 产品技术要求
1.1 联系厂商或者代理人获得必要的文件
1.2 依据CFDA指导原则初定产品标准
1.3 与厂商讨论完善
Step2 检测(只适用于ⅡⅢ类)
2.1 送至检测中心
2.2 检测
2.3 与检测中心讨论,回复意见
2.4 获得检验报告
Step3 临床试验(只适用于部分的ⅡⅢ类)
根据CFDA法规,部分产品在中国做临床试验
3.1 执行临床试验
3.2 完成试验
3.3 获得试验报告
Step 4 CFDA审查
4.1 准备递交文件,确认所有的信息的准确性
4.2 提交给CFDA
4.3 回复意见
4.4 CFDA批准
补充信息
除了生物学评价报告和IEC 60601-1 2nd的报告,CFDA只接受国内的检测报告
医疗器械的标签必须与说明书相符,并且使用中文简体
您也可以访问CFDA官网或者免费的咨询我们来获得更多的信息
电话:010-67889314
2. FDA注册
2.1 FDA公司注册和产品列名(豁免510k)流程
公司注册和产品列名(豁免510k)流程
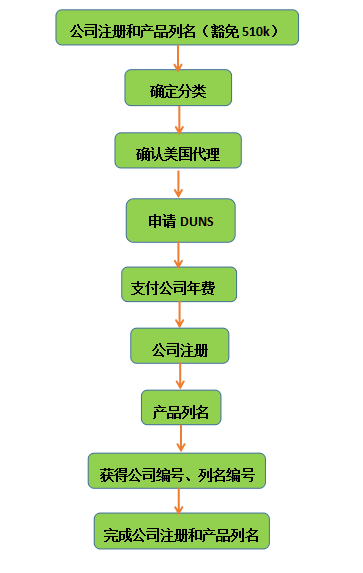
公司注册审核时间90 days 90天
年费(2018)4624($)
2.2 FDA 510(k)流程
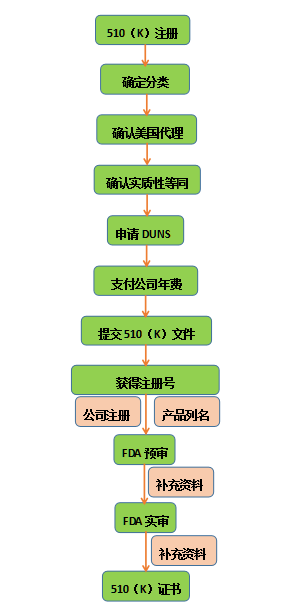
审核时间: 公司注册审核90天
510(k)审核90天
费用: 510(k)审核费用 10566($)
年费4624($)
2.3 FDA PMA申报
3. CE 认证
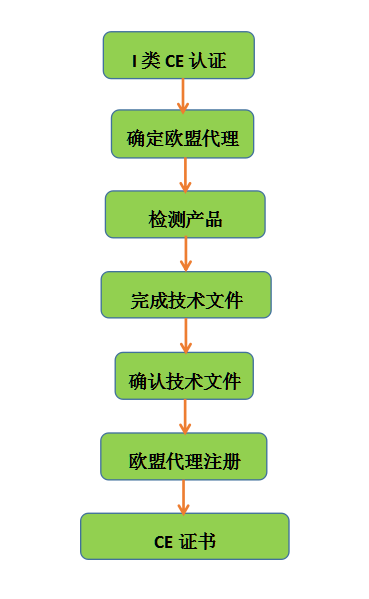
3.1 I类医疗器械CE认证流程
3.2 ⅡⅢ类医疗器械CE认证流程